disminución del punto de congelación
Disminución del punto de congelación es cuando un líquido, como el agua, se congela a una temperatura más baja de lo normal porque se le ha mezclado algo, como sal o azúcar.
NOTA: El agua pura se congela a 0 °C, pero si le echas sal, necesitará estar más fría para convertirse en hielo. Eso pasa porque la sal interfiere con la formación del hielo.
FÓRMULA


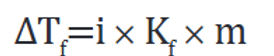
Kf : Constante que es correspondiente al solvente empleado
m: Concentración del soluto en la solución medida en molalidad
∆Tf: Disminución del punto de fusión
Visualizar la siguiente presentación

EJEMPLO

VIDEO EDUCATIVO
APLICACIONES
-
Anticongelantes en automóviles: Se añaden sustancias como etilenglicol al agua del radiador para evitar que se congele en climas fríos.
-
Deshielo de carreteras: Se esparce sal para bajar el punto de congelación del agua y evitar la formación de hielo.
-
Industria alimentaria: Control del congelamiento en productos para conservar textura o evitar daños celulares.


VIDEO EDUCATIVO
